产 品 名 称 | 多糖多酚植物总RNA提取试剂盒 Plant Total RNA Isolation Kit Plus | |
货 号 | RE-05021 | RE-05024 |
规 格 | 50T | 200T |
价 格 | ¥946.00 | ¥3,183.00 |
描 述 | 快速从多种多糖多酚含量高的植物样本中纯化高质量总RNA,试剂盒包含Foregene纯化柱及试剂。 | |
产品介绍
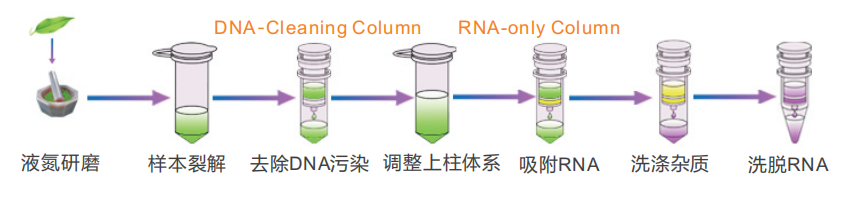
该试剂盒采用本公司研制的离心柱和配方,可以从各种多糖多酚含量高的植物组织中高效率的提取得到高纯度高质量的总RNA。提供DNA-Cleaning Column能轻松的让上清液和组织裂解物分离,去除样品中的DNA,操作简便、省时;RNA-only Column能高效的结合RNA,搭配独特的配方,可以同时处理大量样品。
全体系RNase-Free,使得提取的RNA无降解;Buffer PRW1、Buffer PRW2缓冲液洗涤体系,使得获得的RNA无蛋白、无DNA、无离子、无有机化合物污染。
试剂盒应用
该试剂盒适用于多糖多酚含量高的新鲜或冻存的植物组织样本(尤其是新鲜植物叶片组织)总RNA的提取纯化。
纯化RNA的应用
多糖多酚植物总RNA提取试剂盒提取得到的总RNA可用于各种下游分子实验,例如:cDNA合成,RT-PCR、Real Time PCR、Northern Blot、Dot Blot、体外翻译、芯片分析、PolyA筛选、分子克隆和RNase保护分析等。
RNA提取得率和纯度
使用植物总RNA提取系列试剂盒可以从多种植物组织中纯化得到的RNA,其产量与植物样本本身、样本初始量、样本新鲜程度、样本保存时间以及操作相关。以下是使用该试剂盒提取50mg各种植物样本RNA的得率与纯度,实际操作中,可能与该数据有出入。
新鲜幼嫩叶片 50mg | 总RNA产量 (μg) | OD260/OD280 | OD260/OD230 |
香蕉 | 18-20 | 1.8-2.1 | 1.8-2.1 |
银杏 | 18-20 | 1.8-2.1 | 1.8-2.1 |
棉花 | 12-15 | 1.8-2.1 | 1.8-2.1 |
石榴 | 21-23 | 1.8-2.1 | 1.8-1.9 |
注意:以上数据均得自于植物新鲜叶片,若是植物叶片较老,或是植物其他部位(如叶脉、根茎等),抑或是样本保存时间过久,RNA的得率或低于上表中数据。
储存条件
常温(15–25℃),有效期为 24个月。
试剂盒内容
Buffer PSL1:提供植物组织裂解所需的环境。
Buffer PS:补充多糖多酚含量高的植物组织裂解反应所需的环境。
Buffer PSL2:提供 RNA 的特异上柱环境。
Buffer PRW1:去除 RNA 中的蛋白质、DNA 等杂质。
Buffer PRW2:去除 RNA 中残留的盐离子。
RNase-Free ddH2O:洗脱纯化柱膜上的总 RNA。
DNA-Cleaning Column:特异吸附组织裂解产物中的 DNA,并过滤除去裂解产物 中的固体杂质。
RNA-only Column:特异吸附上通过 DNA-Cleaning Column 滤液中的总 RNA。
产品信息
型号 | 离心柱型 | 纯化组件 | Foregene离心柱、试剂 |
通量 | 1-24个样品 | 制备时间 | ~30 min (24个样品) |
离心机 | 台式离心机 | 植物组织裂解物分离 | 离心分离 |
纯化柱RNA承载量 | 160 μg | 离心柱液体盛装量 | 800 μL |
洗脱体积 | 50-200 μL | 植物样本处理量 | 50 mg |
操作流程
说明书
产品文献
RNAsequencing-based transcriptome analysis of mature strawberry fruit infected bynecrotrophic fungal pathogen Botrytis cinerea
Xiong Jin-Song, Zhu Hong-Yu, Bai Yi-Bo, Liu Hui, Cheng Zong-Ming
南京农业大学园艺学院
Physiological and Molecular Plant Pathology ( IF 1.395 ) Pub Date : 2018-12, DOI:10.1016/j.pmpp.2018.08.005
文章链接:https://www.sciencedirect.com/science/article/pii/S0885576518302091
MSDS
COA
离心柱发生堵塞
Answer
离心柱发生堵塞之后会造成RNA得率降低甚至不能纯化得到RNA,同时提起得到的RNA质量低下。
常见原因分析:
1. 样本破碎不彻底。
样本破碎不彻底会使DNA-Cleaning Column发生堵塞,同时会影响RNA得率及质量。我们建议在进行样本破碎的时候,在足量的液氮中快速研磨操作,尽量破碎样本细胞壁、细胞膜等组织。对于多酚多糖的植物样本,我们建议您使用Plant Total RNA Isolation Kit Plus。
2. 吸取DNA-Cleaning Column分离后的上清液时,吸入了可能的细胞碎片沉淀物。
吸取的细胞碎片沉淀物会使在进行RNA吸附操作时(见操作步骤第5步、多糖多酚操作步骤第六步),将会堵塞RNA-only Column。我们建议在吸取该上清时一定要小心谨慎,以避免细胞碎片被吸取。
3. 样本初始量过多。
样本使用量过多将会造成样本破碎不完全或者Buffer PSL1裂解细胞时不完全,导致纯化操作是纯化柱堵塞。Plant Total RNAIsolation Kit每单次纯化操作样本的初始最大量为50mg。对于多酚多糖的植物样本,我们建议您试用Plant Total RNA Isolation Kit Plus。
4. 离心机的温度过低。
整个RNA分离纯化除了液氮破碎样本组织外,所有的步骤均在常温(20-25℃)进行。有些低温离心机的温度低于20℃,可能会造成DNA-Cleaning Column和(或)RNA-Only Column的堵塞。如果发生这种现象,请将离心机温度设置到20-25℃,并将裂解混合物和(或)添加了乙醇分离上清预热到37℃。
提取不到RNA或者RNA产量低
Answer
通常会有多种因素影响回收效率,比如:样本RNA含量、操作方法、洗脱体积等。
常见原因分析:
1. 操作过程中进行了冰浴或低温(4°C)离心。
建议:全程常温(15-25°C)操作,切勿冰浴和低温离心。
2. 样本保存不当或样本保存时间过久导致RNA已经降解。
建议:新采集的样本应立即放入液氮中速冻,之后长期保存于-80℃并避免样本的反复冻融;或者将样本立即浸泡在RNA稳定剂RNAlater溶液中(动物样本)。
3. 样本破碎裂解不充分导致纯化柱堵塞。
建议:在组织研磨时,请保证组织充分研磨,并在研磨完成后迅速转移至预先准备好的Buffer PSL1(确认已添加正确比例的β-ME,见操作步骤第1步)中。
4. 洗脱液添加不正确。
建议:确认RNase-Free ddH2O滴加到了纯化柱膜中间位置。
5. Buffer PSL2或Buffer PRW2中没有添加正确体积的无水乙醇。
建议:请按照说明书,在试剂盒使用前,Buffer PSL2和Buffer PRW2中添加正确体积的无水乙醇并混匀。
6. 组织样本用量不合适。
建议:每500μl Buffer PSL1使用组织量为50mg,组织使用过多会导致RNA提取量降低并且得到的RNA纯度也会降低。我们强烈建议每单次RNA提取操作,样本初始用量一定不要超过50mg。
7. 洗脱体积不合适或洗脱不彻底。
建议:纯化柱的洗脱液体积为50-200μl;若洗脱效果并不理想,建议在加入预热的RNase-Free ddH2O后,延长室温放置的时间,例如放置5-10min。
8. 纯化柱在BufferPRW2洗涤之后有乙醇残留。
建议:如果在Buffer PRW2洗涤,空管离心1min后还有乙醇残留,可以将空管离心操作的时间增加至2min,或将纯化柱置于室温5min,以充分除去残留乙醇。
9. 试剂盒使用不正确。
建议:对于多酚多糖的植物样本,使用普通的试剂盒如Plant Total RNA Isolation Kit可能不能获得理想的RNA样品,我们建议您使用Plant Total RNA IsolationKit Plus,这是我们专门针对多酚多糖植物样本而研制的专门用于提取多酚多糖类植物样本RNA的试剂盒。
OD260/OD280值偏低
Answer
ddH2O进行RNA洗脱,并用于分光光度计读数时会时OD260/OD280值偏低。我们建议如果要得到相对正确的OD260/OD280值,使用pH7.5 10mM Tris-HCl(而不是RNase-Free ddH2O洗脱RNA),具体见第十九页的“RNA浓度及纯化检测”。
纯化获得的RNA有降解
Answer
纯化得到的RNA的质量和样本的保存、RNase污染、操作等因素有关。
常见原因分析:
1. 组织样本采集后没有及时保存。
建议:组织样本在收集后若不及时使用,请立即低温保存于液氮中或经液氮速冻后立即转移至-80℃长期保存,或者将样本立即浸泡在RNA稳定剂RNAlater溶液中(动物样本)。提取RNA请尽量使用新近采取的组织样本。
2. 组织样本反复冻融。
建议:组织样本保存时,最好剪成小段保存,使用时取出其中一部分即可,避免样本的反复冻融导致RNA的降解。
3. 操作间有RNase引入或没有佩戴一次性手套、口罩等。
建议:RNA提取实验最好在单独的RNA操作间进行,并在实验前清理好实验桌,实验时佩戴一次性手套、口罩,最大程度上避免RNase引入导致的RNA降解。
4. 试剂在使用过程中被RNase污染。
建议:更换新的植物总RNA提取系列试剂盒进行相关实验。
5. RNA操作时所用的离心管、枪头等有RNase污染。
建议:确认RNA提取时所用到的离心管、枪头、移液器等都是RNase-Free。