产 品 名 称 | 病毒DNA/RNA共提试剂盒 Viral DNA&RNA Isolation Kit | |
货 号 | DR-01011 | DR-01013 |
规 格 | 50T | 200T |
价 格 | ¥1,010.00 | ¥3,372.00 |
描 述 | 快速从血浆、血清、无细胞体液和细胞培养上清液等样品中高效率分离纯化病毒的DNA或RNA | |
产品介绍
该试剂盒采用本公司研制的离心柱和配方,可以从血浆、血清、无细胞体液和细胞培 养上清液等样品中高效率分离纯化病毒的 DNA 和 RNA。试剂盒特别了 Linear Acrylamide,可以从体系中轻松捕获微量 DNA 和 RNA,具有方便快捷、产量高、重复 性好的特点。DNA/RNA Column 能高效的结合 DNA 和 RNA,搭配独特的配方,可以 同时处理大量样品。
全体系 RNase-Free,使得纯化得到的病毒核酸无降解;Buffer RW1、Buffer RW2 缓 冲液洗涤体系,使得获得的病毒核酸无蛋白、核酸酶或其它杂质的污染,可直接用于下游分子生物学实验。
试剂盒应用
适用于血浆、血清、无细胞体液和细胞培养上清液等样品中病毒核酸提取纯化。
病毒核酸的应用
Viral DNA/RNA Isolation Kit 纯化得到的病毒 DNA 和 RNA 可用于各种下游分子实验, 例如: Real Time PCR、RT-PCR、RT-qPCR、分子克隆等。
核酸的储存
建议使用 RNase-Free ddH2O 洗脱核酸,即时用于下游实验或储存于-80℃。在-80℃ 存储条件下,核酸可保存一年。
试剂盒组分信息
Linear Acrylamide:降低纯化柱的本底吸附,捕获体系中的微量核酸。
Buffer DRL:提供样本裂解所需的环境以及过柱环境。
Buffer RW1:去除核酸中的蛋白质等杂质。
Buffer RW2:去除核酸中残留的盐离子。
RNase-Free ddH2O:洗脱纯化柱膜上的核酸。
DNA/RNA Column:高效吸附核酸。
产品信息
型号 | 离心柱型 | 纯化组件 | Foregene离心柱、试剂 |
通量 | 1-24个样品 | 制备时间 | ~20min(24个样品) |
离心机 | 台式离心机 | 离心柱液体盛装量 | 800μl |
纯化柱核酸承载量 | 20μg | 样品处理量 | ≤200μl |
洗脱体积 | 30-50μl | ||
操作流程
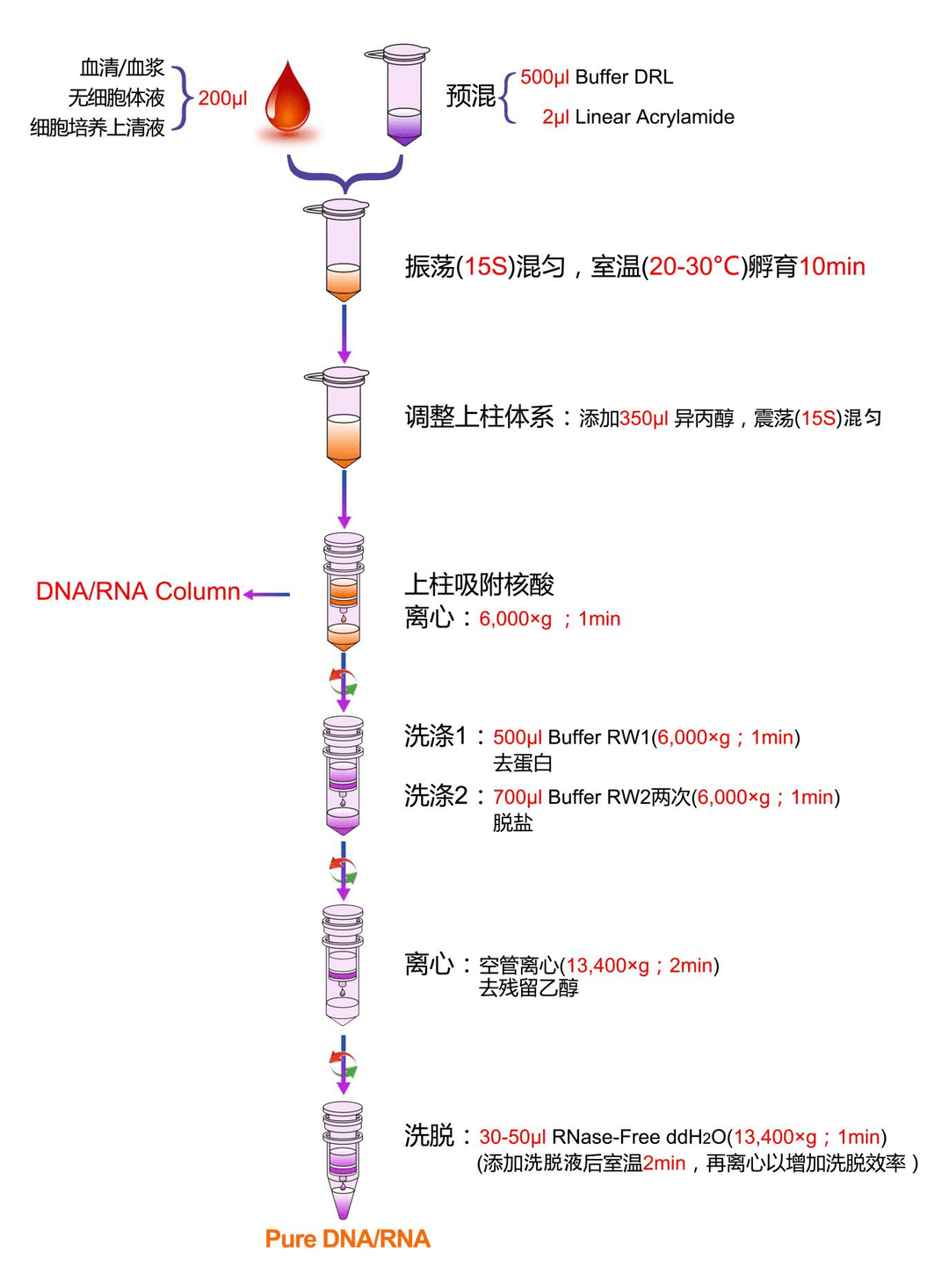
说明书
产品文献
MSDS
COA
纯化获得的核酸影响下游实验
Answer
经纯化柱纯化的DNA和RNA,如果盐离子、蛋白质含量过多会影响下游实验,比如:PCR扩增,逆转录等。
1. 洗脱后的DNA和RNA有盐离子残留。
建议:确认Buffer RW2中添加了正确体积的无水乙醇,并按操作说明的离心转速进行2次纯化柱洗涤;如果还有盐离子残留,可在纯化柱加入Buffer RW2后,室温放置5min,再进行离心操作,以最大程度上去除盐离子污染。
2. 洗脱后的DNA和RNA有乙醇残留。
建议:确认Buffer RW2洗涤后,按操作说明的离心转速进行空管离心操作;如果还有乙醇残留,可以在空管离心后再室温放置5min,以最大程度上去除乙醇残留。
纯化获得的核酸有降解
Answer
纯化得到的核酸的质量和样品的保存、RNase污染、操作等因素有关。
常见原因分析:
1. 采集样品没有及时保存。
建议:样品在采集后若不及时使用,请立即低温保存于-80℃中。提取RNA请尽量使用新近采集的样品。
2. 采集样品反复冻融。
建议:采集样品保存过程中要避免冻融(不超过一次),否则会导致核酸得率降低。
3. 操作间有RNase引入或没有佩戴一次性手套、口罩等。
建议:RNA提取实验最好在单独的RNA操作间进行,并在实验前清理好实验桌,实验时佩戴一次性手套、口罩,最大程度上避免RNase引入导致的RNA降解。
4. 试剂在使用过程中被RNase污染。
建议:更换新的Viral DNA/RNA Isolation Kit进行相关实验。
5. RNA操作时所用的离心管、枪头等有RNase污染。
建议:确认RNA提取时所用到的离心管、枪头、移液器等都是RNase-Free。
提取不到核酸或者核酸产量低
Answer
通常会有多种因素影响回收效率,比如:样本核酸含量、操作方法、洗脱体积等。
常见原因分析:
1. 样品保存不当或样本保存时间过久。
建议:样本保存于-80℃中,并避免反复冻融使用;尽量采用新鲜采集样品进行核酸提取操作。
2. 样品裂解不充分。
建议:请保证样品和裂解工作液彻底混匀,并且在室温(15-25℃)孵育10min。
3. 洗脱液添加不正确。
建议:确认RNase-Free ddH2O滴加到了纯化柱膜中间位置,切勿滴加到纯化柱压圈上。
4. Buffer RW2中没有添加正确体积的无水乙醇。
建议:请按照说明书,在试剂盒使用前,在Buffer RW2中添加正确体积的无水乙醇并混匀。
5. 样品用量不合适。
建议:每500μl Buffer DRL处理样品量200µl,样品处理量过多会导致核酸提取量降低。
6. 洗脱体积不合适或洗脱不彻底。
建议:纯化柱的洗脱液体积为30-50μl;若洗脱效果并不理想,建议在加入预热的RNase-Free ddH2O后,延长室温放置的时间,例如放置5-10min。
7. 纯化柱在Buffer RW2洗涤之后有乙醇残留。
建议:如果在Buffer RW2洗涤,空管离心2min后还有乙醇残留,可以在空管离心后将纯化柱置于室温5min,以充分除去残留乙醇。